Chương 6. Hidrocacbon chưa no
Lý thuyết về alkene
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ hai, 29 Tháng 12 2014 10:35
- Viết bởi Nguyễn Văn Đàm
I. KHÁI NIỆM, ĐỒNG PHÂN, DANH PHÁP
- Alkene hay olefin là hydrocarbon không no, mạch hở trong phân tử có chứa 1 liên kết đôi C=C còn lại là các liên kết đơn.
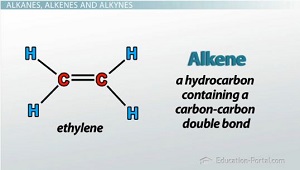
- Công thức tổng quát của alkene: CnH2n (n ≥ 2).
- Tên gọi:
+ Tên thay thế:
Số chỉ vị trí mạch nhánh + tên nhánh + tên mạch chính + số chỉ vị trí nối đôi + ene
+ Tên thường:
Thay đuôi ‘ane’ của alkane bằng đuôi ‘ylene’
Phản ứng cháy của alkene
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ hai, 29 Tháng 12 2014 10:50
- Viết bởi Nguyễn Văn Đàm
Cũng như alkane, alkene tham gia phản cháy dễ dàng cho sản phẩm cháy là H2O và khí CO2. Với cùng số nguyên tử C thì nhiệt lượng giải phóng của alkene lớn hơn do sinh ra ít nước hơn.
- Phản ứng cháy tổng quát của alkene là:
CnH2n + 3n/2O2 → nCO2 + nH2O
Phản ứng cộng của alkene
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ ba, 30 Tháng 12 2014 09:56
- Viết bởi Nguyễn Văn Đàm
Do chứa liên kết pi kém bền (nằm trong liên kết đôi C=C) nên phản ứng đặc trưng của alkene là phản ứng cộng với trung tâm phản ứng là liên kết đôi C=C.
1. Cộng H2
CnH2n + H2 → CnH2n+2 (Ni, t0)
Đặc điểm của phản ứng cộng H2 vào alkene:
+ Tỉ khối của hỗn hợp khí sau phản ứng bao giờ cũng tăng (do số mol khí giảm còn khối lượng thì không đổi) do đó ntrước.Mtrước = nsau.Msau.
Lý thuyết về ankadien
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ ba, 30 Tháng 12 2014 10:11
- Viết bởi Nguyễn Văn Đàm
- Ankađien là những hiđrocacbon không no, mạch hở trong phân tử có chứa 2 liên kết đôi còn lại là các liên kết đơn.
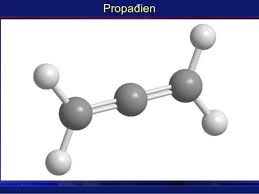
Ankadien đơn giản nhất - C3H4
- Công thức tổng quát: CnH2n-2 (n ≥ 3).
- Danh pháp thay thế: số chỉ vị trí nhánh + tên nhánh + tên mạch chính + a + số chỉ vị trí nối đôi + đien.
Phản ứng cộng của ankadien
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ ba, 30 Tháng 12 2014 10:31
- Viết bởi Nguyễn Văn Đàm
- Ankađien chứa liên kết đôi trong phân tử vì vậy phản ứng đặc trưng của ankađien là phản ứng cộng (tương tự như anken).
- Vi chứa 2 liên kết đôi C=C nên ankađien có thể tham gia vào phản ứng cộng theo tỉ lệ mol 1:1 hoặc 1:2. Phức tạp nhất là trường hợp cộng vào ankađien liên hợp.
- Phản ứng cộng của ankađien có thể xảy ra với các tác nhân: H2, dung dịch Br2 và HX và cũng tuân theo các quy tắc như trường hợp cộng vào anken.
- Dưới đây ta chỉ xét phản ứng cộng vào ankađien liên hợp:
Lý thuyết về ankin
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ ba, 06 Tháng 1 2015 23:53
- Viết bởi Nguyễn Văn Đàm
I. KHÁI NIỆM, ĐỒNG PHÂN, DANH PHÁP
- Ankin là hiđrocacbon không no, mạch hở trong phân tử có chứa 1 liên kết ba CΞC còn lại là các liên kết đơn.
- Công thức tổng quát của ankin: CnH2n-2 (n ≥ 2).
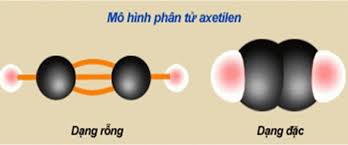
Ankin đơn giản nhất - C2H2 (axetilen)
- Tên gọi:
+ Tên thay thế:
Số chỉ vị trí mạch nhánh + tên nhánh + tên mạch chính + số chỉ vị trí nối ba + in
+ Tên thường:
Tên gốc hiđrocacbon gắn với C mang liên kết ba + axetilen
Phản ứng cộng của ankin
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ sáu, 09 Tháng 1 2015 06:57
- Viết bởi Nguyễn Văn Đàm
Phân tử ankin có chứa 1 liên kết ba. Liên kết ba này được tạo nên từ một liên kết xichma bền và 2 liên kết pi kém bền dễ bị phá vỡ. Vì vậy ankin dễ dàng tham gia vào các phản ứng cộng. Phản ứng cộng của ankin cũng có nhiều điểm tương tự như phản ứng cộng ở anken. Tuy nhiên vì có 2 liên kết pi nên ankin có thể tham gia phản ứng cộng theo tỉ lệ 1:1 hoặc 1:2.
I. PHẢN ỨNG CỘNG
1. Cộng H2
CnH2n-2 + H2 → CnH2n (Pd/PbCO3, t0)
CnH2n-2 + 2H2 → CnH2n+2 (Ni, t0)
Chú ý:
Phản ứng cháy của ankin
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ sáu, 09 Tháng 1 2015 08:27
- Viết bởi Nguyễn Văn Đàm
Phản ứng đốt cháy ankin là phản ứng hay gặp trong các đề thi. Thường gặp ở 2 dạng: đốt cháy ankin (hoặc hỗn hợp ankin) và đốt cháy hỗn hợp ankin với các hiđrocacbon khác.
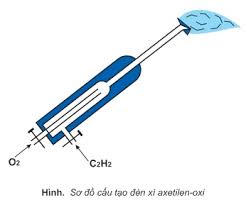
Phản ứng cháy của C2H2 tỏa nhiều nhiệt được ứng dụng làm đèn xì axetilen - oxi
1. Phản ứng cháy của ankin
CnH2n-2 + (3n - 1)/2O2 → nCO2 + (n - 1)H2O
Đặc điểm của phản ứng đốt cháy ankin: nCO2 > nH2O và nCO2 - nH2O = nankin.
Phản ứng thế của ankin
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Thứ hai, 19 Tháng 1 2015 08:04
- Viết bởi Nguyễn Văn Đàm
- Ank-1-in là những ankin có liên kết ba ở đầu mạch. Chỉ những ankin loại này mới tham gia vào phản ứng thế ion Ag+ được.
- Phản ứng thế nguyên tử H ở nguyên tử C mang liên kết ba là phản ứng đặc trưng và rất hay gặp đối với ankin.
Ví dụ:
CH≡CH + Ag2O → CAgΞCAg↓ (vàng) + H2O
(Bạc axetilua)
2CHΞC-R + Ag2O → 2CAgΞC-R↓ (vàng) + H2O
Chú ý:
Phản ứng cháy của ankađien
- Chi tiết
- Chuyên mục: Chương 6. Hidrocacbon chưa no
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 16:47
- Viết bởi Nguyễn Văn Đàm
Cũng như các hiđrocacbon khác ankađien dễ dàng tham gia phản ứng cháy cho sản phẩm gồm CO2 và H2O theo phương trình tổng quát sau:
CnH2n-2 + (3n-1)/2 O2 → n CO2 + (n-1)H2O
Dựa vào phương trình phản ứng trên ta có thể nhận thấy đặc điểm phản ứng cháy của ankađien:
