Chuyên đề 14. Andehit - Xeton - Axit cacboxylic
Lí thuyết về axit cacboxylic
- Chi tiết
- Chuyên mục: Chuyên đề 14. Andehit - Xeton - axit cacboxylic
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 16:53
- Viết bởi Nguyễn Văn Đàm
I. ĐỊNH NGHĨA
- Các định nghĩa về axit cacboxylic:
+ Axit cacboxylic là hợp chất hữu cơ mà phân tử có nhóm - COOH liên kết với gốc hiđrocacbon, với H hoặc với nhau.
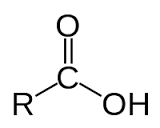
+ Axit cacboxylic là sản phẩm thu được khi thay nguyên tử H trong hiđrocacbon hoặc H2 bằng nhóm - COOH.
- Công thức tổng quát của axit:
+ CxHyOz (x, y, z là các số nguyên dương; y chẵn; z chẵn; 2 ≤ y ≤ 2x + 2 - 2z;): thường dùng khi viết phản ứng cháy.
+ CxHy(COOH)z hay R(COOH)z: thường dùng khi viết phản ứng xảy ra ở nhóm COOH.
+ CnH2n+2-2k-z(COOH)z (k = số liên kết p + số vòng): thường dùng khi viết phản ứng cộng H2, cộng Br2…
- Một số loại axit hữu cơ thường gặp:
+ Axit no đơn chức: CnH2n+1COOH (n ≥ 0) hoặc CmH2mO2 (m ≥ 1).
+ Axit hữu cơ không no, mạch hở, đơn chức trong gốc hiđrocacbon có 1 liên kết đôi: CnH2n-1COOH (n ≥ 2) hoặc CmH2m-2O2 (m ≥ 3).
+ Axit hữu cơ no, 2 chức, mạch hở: CnH2n(COOH)2 (n ≥ 0).
II. DANH PHÁP
1. Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + oic
2. Tên thường của một số axit thường gặp
HCOOH Axit fomic
CH3COOH Axit axetic
CH3CH2COOH Axit propionic
CH3CH2CH2COOH Axit butiric
CH2=CH-COOH Axit acrylic
CH2=C(CH3)-COOH Axit metacrylic
(COOH)2 Axit oxalic
C6H5COOH Axit benzoic
HOOC(CH2)4COOH Axit ađipic
C15H31COOH Axit pamitic
C17H35COOH Axit stearic
C17H33COOH Axit oleic
C17H31COOH Axit linoleic
III. TÍNH CHẤT VẬT LÍ
1. Nhiệt độ sôi
Axit có nhiệt độ sôi cao hơn Ancol có khối lượng phân tử tương đương vì phân tử axit tạo được 2 liên kết H và liên kết H giữa các phân tử axit bền hơn liên kết H giữa các phân tử Ancol.
2. Tính tan
- Từ C1 đến C3 tan vô hạn trong nước do có khả năng tạo liên kết H liên phân tử với nước.
- C4 đến C5 ít tan trong nước; từ C6 trở lên không tan do gốc R cồng kềnh và có tính kị nước.
IV. TÍNH CHẤT HOÁ HỌC
1. Tính axit
a. So sánh tính axit giữa các phân tử axit
- Phân tử axit có nhóm cacbonyl C = O là nhóm hút e mạnh nên làm giảm mật độ e tự do trên nguyên tử O làm cho liên kết O - H bị phân cực hơn → dễ bị phân li thành H+ thể hiện tính axit.
RCOOH ↔ RCOO- + H+
(RCOOH + H2O ↔ RCOO- + H3O+)
- Độ mạnh của axit phụ thuộc vào độ linh động của nguyên tử H và độ tan của axit trong dung môi nước.
- Nếu nhóm COOH gắn với nhóm đẩy e (gốc hiđrocacbon no) thì tính axit yếu hơn so với HCOOH. Gốc ankyl càng có nhiều nguyên tử H thì đẩy e càng mạnh làm cho tính axit càng giảm.
- Nếu nhóm COOH gắn với nhóm hút e (gốc hiđrocacbon không no, gốc có chứa nhóm NO2, halogen, OH…) thì tính axit mạnh hơn so với HCOOH. Càng nhiều gốc hút e thì tính axit càng mạnh. Gốc hút e càng mạnh thì tính axit càng mạnh, nhóm hút e nằm càng gần nhóm COOH thì làm cho tính axit của axit càng mạnh.
b. Các phản ứng thể hiện tính axit
- Axit làm quỳ tím chuyển thành màu hồng.
- Tác dụng với bazơ → muối + H2O
R(COOH)x + xNaOH → R(COONa)x + xH2O
- Tác dụng với oxit bazơ → muối + H2O
2R(COOH)x + xNa2O → 2R(COONa)x + xH2O
- Tác dụng với kim loại đứng trước H → muối + H2
2R(COOH)x + xMg → [2R(COO)x]Mgx + xH2
→ Phản ứng này có thể dùng để nhận biết axit.
- Tác dụng với muối của axit yếu hơn (muối cacbonat, phenolat, ancolat) → muối mới + axit mới.
R(COOH)x + xNaHCO3 → R(COONa)x + xH2O + xCO2
→ Thường dùng muối cacbonat hoặc hiđrocacbonat để nhận biết các axit.
2. Phản ứng este hóa
R(COOH)x + R’(OH)t → Ry(COO)xyR’x + xyH2O (H2SO4, t0)
3. Phản ứng tách nước
2RCOOH → (RCO)2O + H2O (P2O5)
4. Phản ứng oxi hóa hoàn toàn
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Nếu đốt cháy axit thu được nCO2 = nH2O thì axit thuộc loại no, đơn chức, mạch hở:
CnH2n+1COOH → (n + 1)CO2 + (n + 1)H2O
Chú ý:
- HCOOH có phản ứng tương tự như anđehit:
HCOOH + 2AgNO3 + 4NH3 + H2O → 2NH4NO3 + (NH4)2CO3 + 2Ag
- Các axit không no còn có các tính chất của hiđrocacbon tương ứng:
CH2=CH-COOH + Br2 dung dịch → CH2Br-CHBr-COOH
3CH2=CH-COOH + 2KMnO4 + 4H2O → 3CH2OH-CHOH-COOH + 2MnO2 + 2KOH
Sản phẩm cộng của CH2 = CH - COOH với HX trái với Maccopnhicop
- Axit thơm có phản ứng thế vào vị trí meta.
- Axit no có phản ứng thế vào vị trí α.
V. ĐIỀU CHẾ
1. Oxi hóa anđehit
R(CHO)x + x/2O2 → R(COOH)x (xúc tác Mn2+, t0)
2. Thủy phân este trong môi trường axit
Ry(COO)xyR’x + xyH2O ↔ yR(COOH)x + xR’(OH)y
3. Thủy phân dẫn xuất 1,1,1 - trihalogen
RCCl3 + 3NaOH → RCOOH + 3NaCl + H2O (H2O)
4. Riêng CH3COOH
n-C4H10 + 5/2O2 → 2CH3COOH + H2O (xúc tác Mn2+, t0)
C2H5OH + O2 → CH3COOH + H2O (men giấm)
5. Một số phản ứng khác
C6H5-CH3 → C6H5COOK → C6H5COOH
R-X → R-CN → R-COOH
CH3OH + CO → CH3COOH
VI. NHẬN BIẾT
- Làm quỳ tím chuyển thành màu đỏ; tác dụng với kim loại giải phóng H2; tác dụng với muối cacbonat hoặc hiđrocacbonat giải phóng khí CO2.
- Axit không no làm mất màu dung dịch Br2, dung dịch thuốc tím.
- HCOOH có phản ứng tương tự andehit: tạo được kết tủa trắng với AgNO3/NH3…
Hochoaonline.net giới thiệu các câu hỏi lí thuyết thường gặp về axit cacboxylic: