Chuyên đề 12. Hiđrocacbon
Lý thuyết về hiđrocacbon thơm
- Chi tiết
- Chuyên mục: Chuyên đề 12. Hidrocacbon
- Được viết ngày Thứ hai, 19 Tháng 1 2015 08:43
- Viết bởi Nguyễn Văn Đàm
Hiđrocacbon thơm là hiđrocacbon trong phân tử có chứa vòng benzen trong phân tử.
Một số hidrocacbon thơm thường gặp
I. BENZEN
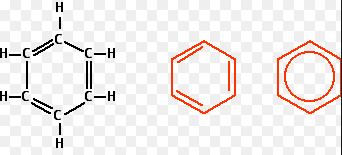
- Công thức phân tử: C6H6.
- Công thức cấu tạo: Phân tử benzen gồm 6 nguyên tử H và 6 nguyên tử C nằm trong cùng một mặt phẳng trong đó 6 nguyên tử C tạo thành hình lục giác đều, mỗi nguyên tử C lại liên kết với một nguyên tử H nữa. Độ dài các liên kết C-C bằng nhau, độ dài các liên kết C-H cũng như nhau.
1. Tính chất hóa học
a. Phản ứng thế
C6H6 + Br2 → C6H5Br + HBr (Fe, t0)
C6H6 + HNO3 → C6H5NO2 + H2O (H2SO4 đặc, t0)
b. Phản ứng cộng
C6H6 + 3H2 → xiclohexan (Ni, t0)
C6H6 + 3Cl2 → C6H6Cl6 (as) (hexacloran hay 666 hay 1,2,3,4,5,6 - hexacloxiclohexan)
c. Phản ứng oxi hóa
- Benzen không làm mất màu dung dịch KMnO4.
- Oxi hóa hoàn toàn:
C6H6 + 7,5O2 → 6CO2 + 3H2O (t0)
2. Nhận biết benzen
- Thuốc thử: là hỗn hợp HNO3 đặc nóng/H2SO4 đặc.
- Hiện tượng: xuất hiện chất lỏng có màu vàng, mùi hạnh nhân nổi trên bề mặt.
3. Điều chế benzen
- Từ axetilen:
3C2H2 → C6H6 (C, 6000C)
- Tách H2 từ xiclohexan:
C6H12→ C6H6 + 3H2 (t0, xt)
- Tách H2 và khép vòng từ n - C6H14:
n - C6H14 → C6H6 + 4H2 (xt, t0)
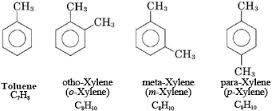
II. ĐỒNG ĐẲNG CỦA BENZEN
- Là những hiđrocacbon trong phân tử có chứa 1 vòng benzen và nhánh ankyl.
- Công thức chung: CnH2n-6 (n > 6).
Hay gặp là toluen C6H5CH3, xilen C6H4(CH3)2, cumen C6H5CH(CH3)2…
1. Tính chất hóa học
a. Phản ứng thế
- Quy tắc thế vào vòng benzen:
+ Nếu vòng benzen đã có sẵn nhóm thế loại I (là các nhóm chỉ chứa liên kết đơn hoặc có cặp e chưa sử dụng: -OH, ankyl, …) thì phản ứng thế xảy ra dễ hơn so với benzen và ưu tiên thế vào vị trí o- và p-.
+ Nếu vòng benzen đã có sẵn nhóm thế loại II (là những nhóm thế có liên kết p: -COOH, -CHO, -CH=CH2) thì phản ứng thế xảy ra khó hơn so với benzen và ưu tiên thế vào vị trí m-.
Chú ý: Vận dụng quy tắc thế vào vòng benzen thường được đưa ra dưới 2 dạng toán:
+ So sánh khả năng tham gia phản ứng thế vào vòng benzen của các hợp chất thơm.
+ Sử dụng thứ tự hóa chất thích hợp để điều chế o - (p -) hoặc m- NO2-C6H4-Br…
- Do các đồng đẳng của benzen còn có nhánh ankyl nên trong điều kiện thích hợp có thể thế H của nhánh ankyl.
C6H5CH3 + Cl2 → C6H5CH2Cl + HCl (as)
b. Phản ứng cộng
CnH2n-6 + 3H2 → xicloankan CnH2n (Ni, t0)
C6H5CH3 + 3H2 → C6H11CH3 (Ni, t0)
c. Phản ứng oxi hóa
- Oxi hóa không hoàn toàn: các đồng đẳng của benzen làm mất màu dung dịch thuốc tím ở nhiệt độ cao mà không làm mất màu dung dịch nước Brom.
C6H5CH3 + 2KMnO4 → C6H5COOK + KOH + 2MnO2 + H2O (t0)
- Oxi hóa hoàn toàn:
CnH2n-6 + (3n - 3)/2O2 → nCO2 + (n - 3)H2O (t0)
Đặc điểm của phản ứng đốt cháy benzen và đồng đẳng: nH2O < nCO2 và (nCO2 - nH2O)/3 = nRH.
2. Nhận biết đồng đẳng của benzen
Đồng đẳng benzen làm mất màu dung dịch thuốc tím ở nhiệt độ cao.
III. STIREN (VINYL BENZEN)
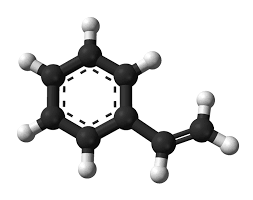
- Công thức phân tử C8H8.
- Công thức cấu tạo: C6H5-CH=CH2.
1. Tính chất hóa học
Nhận xét: phân tử stiren được cấu tạo từ 2 phần: vòng benzen và nhánh vinyl (nhóm thế loại II) → tính chất hóa học của stiren được biểu hiện cả ở vòng benzen và nhánh.
a. Phản ứng thế vào vòng benzen
Ưu tiên thế vào vị trí meta.
b. Phản ứng cộng
C6H5-CH=CH2 + H2 → C6H5-CH2-CH3 (Ni, t0)
C6H5-CH=CH2 + 4H2 → C6H11-CH2-CH3 (Ni, t0)
C6H5-CH=CH2 + Br2 dung dịch → C6H5-CHBr-CH2Br
c. Phản ứng trùng hợp
n-C6H5-CH=CH2 → (-CH2-CH(C6H5)-)n (t0, xt, p)
(Polstiren - PS)
d. Phản ứng oxi hóa không hoàn toàn
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ thường:
3C6H5CH=CH2 + 2KMnO4 + 4H2O → 3C6H5-CHOH-CH2OH + 2KOH + 2MnO2
- Stiren làm mất màu dung dịch thuốc tím ở nhiệt độ cao:
3C6H5-CH=CH2 + 10KMnO4 → 3C6H5COOK + 3K2CO3 + KOH + 10MnO2 + 4H2O
2. Nhận biết
- Làm mất màu dung dịch Brom.
- Làm mất màu dung dịch thuốc tím ở nhiệt độ thường.
Mời các bạn tham khảo bài tập sau của hochoaonline.net: