Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
Cấu tạo nguyên tử và bài toán các hạt cơ bản
- Chi tiết
- Chuyên mục: Chuyên đề 1. Cấu tạo nguyên tử, bảng tuần hoàn, liên kết hóa học
- Được viết ngày Chủ nhật, 08 Tháng 2 2015 10:17
- Viết bởi Nguyễn Văn Đàm
Nguyên tử là các hạt vô cùng nhỏ bé nhưng nó lại có cấu tạo phức tạp.
1. Cấu tạo nguyên tử
Nguyên tử gồm 2 phần:
- Vỏ nguyên tử: gồm các electron (e) chuyển động rất nhanh: me = 9,1094.10-31kg; qe = -1,602.10-19C.
- Hạt nhân nguyên tử: hầu hết đều được tạo thành từ proton và nơtron (trừ nguyên tử 1H trong hạt nhân không có nơtron).
+ Proton (p): mp = 1,6726.10-27kg; qp = 1,602.10-19C.
+ Nơtron (n): mn = 1,6748.10-27kg; qn = 0.

2. Kích thước và khối lượng của nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ bé.
- Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân (vì khối lượng của e rất nhỏ bé). Do đó một cách gần đúng có thể coi khối lượng nguyên tử là khối lượng của hạt nhân.
3. Mối quan hệ giữa các loại hạt trong nguyên tử
- Vì nguyên tử trung hòa về điện nên trong mọi nguyên tử luôn có: số p = số e.
- Với nguyên tử bền: số p ≤ số n ≤ 1,5.số p (các nguyên tử có số p ≥ 82 thì không bền là những chất phóng xạ).
4. Các đại lượng đặc trưng của nguyên tử và cách kí hiệu nguyên tử
Nguyên tử có 2 đại lượng đặc trưng là số đơn vị điện tích hạt nhân (Z) và số khối (A).
- Số đơn vị điện tích hạt nhân (Z) = số electron (E) = số proton (P) = số hiêu nguyên tử.
- Số khối (A) = Z + N (số nơtron).
Cách kí hiệu đầy đủ của nguyên tử X: ZAX.
5. Nguyên tố hóa học và đông vị
- Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
- Đồng vị là hiện tượng các nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
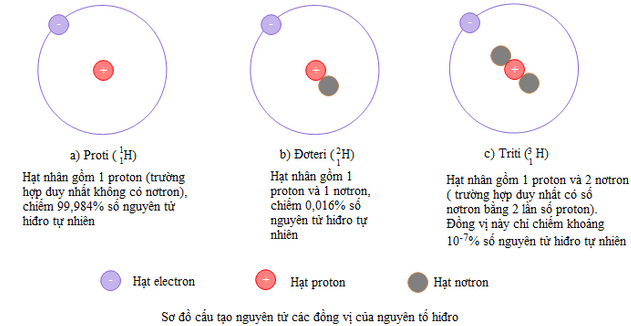
- Số khối: A = Z + N.
- Số khối A và số proton (số đơn vị điện tích hạt nhân, số hiệu nguyên tử) Z là 2 đại lượng đặc trưng cho nguyên tử.
Hochoaonline.net giới thiệu đến các bạn các bài tập về cấu tạo nguyên tử và bài toán các hạt cơ bản sau: