Chương 9. Andehit, xeton, axit cacboxylic
Lý thuyết về anđehit - xeton
- Chi tiết
- Chuyên mục: Chương 9. Andehit, xeton, axit cacboxylic
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 23:24
- Viết bởi Nguyễn Văn Đàm
A. ANĐEHIT
I. Định nghĩa
- Các định nghĩa có thể dùng với anđehit:
+ Anđehit là HCHC mà phân tử có nhóm - CHO liên kết với gốc hiđrocacbon, với H hoặc với nhau.
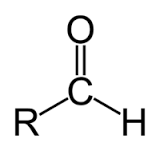
+ Anđehit là sản phẩm thu được khi thay nguyên tử H trong hiđrocacbon hoặc H2 bằng nhóm -CHO.
+ Andehit là HCHC mà phân tử có nhóm -CHO liên kết trực tiếp với C hoặc H
- Công thức tổng quát của anđehit:
+ CxHyOz (x, y, z là các số nguyên dương; y chẵn; 2 ≤ y ≤ 2x + 2 - 2z; z ≤ x): thường dùng khi viết phản ứng cháy.
+ CxHy(CHO)z hay R(CHO)z: thường dùng khi viết phản ứng xảy ra ở nhóm CHO.
+ CnH2n+2-2k-z(CHO)z (k = số liên kết p + số vòng): thường dùng khi viết phản ứng cộng H2, cộng Br2…
II. Danh pháp
1. Tên thay thế
Tên thay thế = Tên hiđrocacbon tương ứng + al
2. Tên thường
Tên thường = Anđehit + Tên axit tương ứng
Tên axit (thay hậu tố ‘ic’ bằng ‘anđehit’)
Chú ý: Dung dịch HCHO 37% → 40% gọi là: Fomalin hay fomon.
III. Tính chất vật lí
- Chỉ có HCHO, CH3CHO là chất khí. Các anđehit còn lại đều là chất lỏng.
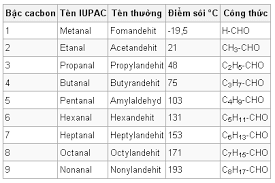
- Anđehit có nhiệt độ sôi thấp hơn Ancol có khối lượng phân tử tương đương nhưng cao hơn so với hidrocacbon có cùng số nguyên tử C trong phân tử.
IV. Tính chất hóa học
1. Phản ứng với hiđro
R(CHO)x + xH2 → R(CH2OH)x (xúc tác Ni, t0)
Chú ý:
- Trong phản ứng của anđehit với H2: Nếu gốc R có các liên kết pi thì H2 cộng vào cả các liên kết pi đó.
- Phản ứng với H2 chứng tỏ anđehit có tính oxi hóa.
2. Phản ứng với AgNO3/NH3 (phản ứng tráng bạc)
R(CHO)x + 2xAgNO3 + 3xNH3 + xH2O → R(COONH4)x + xNH4NO3 + 2xAg
- Phản ứng chứng minh anđehit có tính khử và được dùng để nhận biết anđehit.
- Riêng HCHO có phản ứng:
HCHO + 4AgNO3 + 6NH3 + 2H2O → (NH4)2CO3 + 4NH4NO3 + 4Ag
Chú ý:
- Phản ứng tổng quát ở trên áp dụng với anđehit không có nối ba nằm đầu mạch. Nếu có nối ba nằm ở đầu mạch thì H của C nối ba cũng bị thay thế bằng Ag.
- Các đặc điểm của phản ứng tráng gương của anđehit:
+ Nếu nAg = 2nanđehit → anđehit thuộc loại đơn chức và không phải HCHO.
+ Nếu nAg = 4nanđehit → anđehit đó thuộc loại 2 chức hoặc HCHO.
+ Nếu nAg > 2nhỗn hợp các anđehit đơn chức thì hỗn hợp đó có HCHO.
+ Số nhóm CHO = nAg/2nanđehit (nếu trong hỗn hợp không có HCHO).
- Một số loại chất khác cũng có khả năng tham gia phản ứng tráng gương gồm:
+ HCOOH và muối hoặc este của nó: HCOONa, HCOONH4, (HCOO)nR. Các chất HCHO, HCOOH, HCOONH4 khi phản ứng chỉ tạo ra các chất vô cơ.
+ Các tạp chức có chứa nhóm chức CHO: glucozơ, fructozơ, mantozơ…
3. Phản ứng oxi hóa
a. Oxi hóa hoàn toàn
CxHyOz + (x + y/4 - z/2)O2 → xCO2 + y/2H2O
Nếu đốt cháy anđehit mà nCO2 = nH2O thì anđehit thuộc loại no, đơn chức, mạch hở.
CnH2n+1CHO → (n + 1)CO2 + (n + 1)H2O
b. Phản ứng oxi hóa không hoàn toàn
R(CHO)x + x/2O2 → R(COOH)x (xúc tác Mn2+, t0)
Đối với bài toán oxi hóa anđehit thành axit cần chú ý định luật bảo toàn khối lượng trong quá trình giải.
4. Phản ứng với Cu(OH)2 ở nhiệt độ cao
R(CHO)x + 2xCu(OH)2↓ → R(COOH)x + xCu2O↓ + 2xH2O
xanh đỏ gạch
→ Phản ứng này được dùng để nhận biết anđehit.
Chú ý: Phản ứng với Cu(OH)2 thường được thực hiện trong môi trường kiềm nên có thể viết phản ứng dưới dạng:
R(CHO)x + 2xCu(OH)2 + xNaOH → R(COONa)x + xCu2O + 3xH2O
HCOOH, HCOOR, HCOOM, glucozơ, fructozơ, mantozơ cũng có phản ứng này.
5. Phản ứng với dung dịch Br2
R(CHO)x + xBr2 + xH2O → R(COOH)x + 2xHBr
Nếu anđehit còn có liên kết pi ở gốc hiđrocacbon thì xảy ra đồng thời phản ứng cộng Br2 vào liên kết pi đó.
V. Điều chế
1. Oxi hóa ancol bậc I
R(CH2OH)x + xCuO → R(CHO)x + xCu + xH2O (t0)
2. Điều chế qua ancol không bền
- Cộng H2O vào C2H2:
C2H2 + H2O → CH3CHO (H2SO4, HgSO4, 800C)
- Thủy phân este của ancol không bền thích hợp:
CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO
- Thủy phân dẫn xuất 1,1-đihalogen:
CH3-CHCl2 + 2NaOH → CH3CHO + 2NaCl + H2O
3. Một số phản ứng đặc biệt
2CH3OH + O2 → 2HCHO + 2H2O (Ag, 6000C)
CH4 + O2 → HCHO + H2O (xúc tác, t0)
2CH2=CH2 + O2 → 2 CH3CHO (PdCl2, CuCl2)
VI. Nhận biết anđehit
- Tạo kết tủa sáng bóng với AgNO3/NH3.
- Tạo kết tủa đỏ gạch với Cu(OH)2 ở nhiệt độ cao.
- Làm mất màu dung dịch nước Brom.
(Riêng HCHO phản ứng với dung dịch Brom có khí CO2 thoát ra).
VII. Ứng dụng
- Fomandehit được dùng chủ yếu để sản xuất poliphenolfomandehit (làm chất dẻo), dùng trong tổng hợp phẩm nhuộm, dược phẩm.
- Dung dịch 37 - 40% của fomandehit trong nước gọi là fomon hay fomalin dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng...
- Axetandehit được dùng chủ yếu để sản xuất axit axetic.
B. XETON
I. Định nghĩa
- Xeton là HCHC mà phân tử có nhóm chức -C(=O)- liên kết trực tiếp với 2 nguyên tử C.
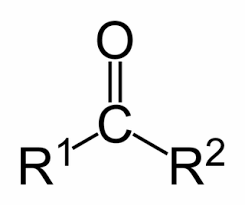
- CTTQ của xeton đơn chức có dạng: R - CO - R’
II. Danh pháp
1. Tên thay thê
Tên thay thế = Tên hidrocacbon + số chỉ vị trí C trong nhóm CO + on
2. Tên gốc - chức
Tên gốc chức = Tên gốc R, R’ + xeton
III. Tính chất hóa học
- Phản ứng với H2/Ni, t0 tạo ancol bậc II:
R-CO-R’ + H2 → R-CHOH-R’
- Xeton không có phản ứng tráng gương, không phản ứng với Cu(OH)2 ở nhiệt độ cao, không làm mất màu dung dịch Brom như anđehit.
- Phản ứng thế ở gốc hidrocacbon vị trí bên cạnh nhóm CO:
CH3COCH3 + Br2 → CH3COCH2Br + HBr (có CH3COOH)
IV. Điều chế
- Cho ancol bậc II + CuO đun nóng:
RCHOHR’ + CuO → RCOR’ + Cu + H2O
- Điều chế gián tiếp qua ancol không bền:
CH3COOC(CH3) = CH2 + NaOH → CH3COONa + CH3COCH3
- Oxi hóa cumen (C6H5CH(CH3)2) để sản xuất axeton.
V. Ứng dụng
- Axeton được dùng làm dung môi trong sản xuất nhiều hóa chất.
- Axeton còn là chất đầu để tổng hợp nhiều chất hữu cơ quan trọng khác.
Hochoaonline.net giới thiệu đến bạn đọc các câu hỏi lí thuyết về anđehit và xeton:
