Chương 5. Nhóm VIIA. Halogen
Lý thuyết về HCl
- Chi tiết
- Chuyên mục: Chương 5. Nhóm VIIA. Halogen
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 22:15
- Viết bởi Nguyễn Văn Đàm
HCl và muối clorua là những hợp chất rất quan trọng của nguyên tố clo.
A. HIĐRO CLORUA, AXIT CLOHIĐRIC
1. Tính chất vật lí
- Hidro clorua là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
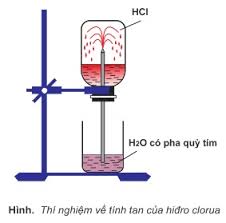
- Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
2. Tính chất hóa học
a. Tính axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với kim loại đứng trước H → muối trong đó kim loại có hóa trị thấp + H2.
Fe + 2HCl → FeCl2 + H2
- Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
- Tác dụng với bazơ → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
- Tác dụng với muối → muối mới + axit mới
Na2CO3 + 2HCl → 2NaBr + H2O + CO2
b. Tính oxi hóa - khử
- HCl thể hiện tính oxi hóa khi tác dụng với các kim loại đứng trước H2 (xem phần tính axit).
- HCl đóng vai trò chất khử khi tác dụng với chất có tính oxi hóa mạnh (xem phản ứng điều chế clo trong phòng thí nghiệm).
3. Điều chế
- Phương pháp sunfat (trong phòng thí nghiệm):
NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (< 2500C)
2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (> 4000C)
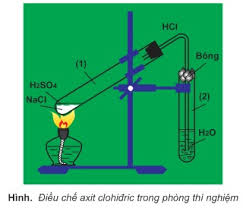
- Phương pháp tổng hợp (trong công nghiệp):
H2 + Cl2 → 2HCl (đun nóng)
B. MUỐI CLORUA
- Muối của axit clohidric được gọi là muối clorua.
- Công thức tổng quát: MCln.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2Cl2.
- Để nhận biết ion Cl- có thể dùng thuốc thử là dung dịch AgNO3 do tạo thành AgCl kết tủa trắng (AgCl tan trong dung dịch amoniac do tạo phức với NH3):
AgNO3 + NaCl → AgCl + NaNO3

Hochoaonline.net giới thiệu đến các bạn các câu hỏi lí thuyết về loại chất này:
