Chương 3. Liên kết hóa học
Khái niệm và sự hình thành liên kết hoá học
- Chi tiết
- Chuyên mục: Chương 3. Liên kết hóa học
- Được viết ngày Thứ sáu, 27 Tháng 2 2015 22:05
- Viết bởi Nguyễn Văn Đàm

Liên kết hóa học là sự kết hợp giữa các nguyên tử hoặc ion để tạo thành phân tử hay tinh thể bền vững. Khi tạo thành liên kết hóa học, các nguyên tử thường có xu hướng đạt tới cấu hình e bền vững của khí hiếm với 8e (của He là 2e) ở lớp ngoài cùng.
Có các kiểu liên kết hóa học chủ yếu sau:
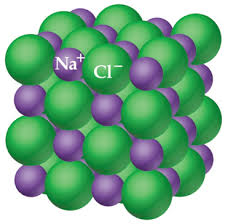
I. LIÊN KẾT ION
1. Khái niệm và phân loại ion
- Ion là nguyên tử hoặc nhóm nguyên tử mang điện tích.
- Phân loại ion:
+ Theo điện tích: ion dương (cation) và ion âm (cation).
+ Theo số nguyên tử tạo nên ion: ion đơn nguyên tử (chỉ có 1 nguyên tử) và ion đa nguyên tử (do nhiều nguyên tử tạo nên).
2. Sự hình thành ion từ nguyên tử
- Nguyên tử có xu hướng nhường hoặc nhận e để đạt đến cấu hình e bền vững của khí hiếm (có 8e ở lớp ngoài cùng).
- Phi kim A nhóm nA:
A + (8 – n)e → An-8
- Kim loại M nhóm nA:
M → Mn+ + ne.
3. Liên kết ion
Là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
4. Tính chất chung của hợp chất ion
- Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể, có tính bền vững, thường có nhiệt độ nóng chảy và nhiệt độ sôi khá cao.
- Các hợp chất ion thường tan nhiều trong nước. Khi nóng chảy hoặc khi hòa tan trong nước có khả năng dẫn điện.
II. LIÊN KẾT CỘNG HÓA TRỊ
1. Khái niệm và phân loại
- Liên kết cộng hóa trị là liên kết được tạo nên giữa 2 nguyên tử bằng 1 hoặc nhiều cặp e chung.
- Liên kết cộng hóa trị gồm 2 loại:
+ Liên kết cộng hóa trị có cực (liên kết cộng hóa trị phân cực): cặp e chung bị hút lệch về phía nguyên tử có độ âm điện lớn hơn.

+ Liên kết cộng hóa trị không cực (liên kết cộng hóa trị không phân cực): cặp e chung không bị hút lệch về phía nguyên tử nào.

2. Đặc điểm của hợp chất cộng hóa trị
- Các phân tử chỉ có liên kết cộng hóa trị có thể tồn tại ở thể rắn, lỏng hoặc khí.
- Các chất có cực tan nhiều trong dung môi có cực. Phần lớn các chất không cực tan trong dung môi không cực.
- Các chất chỉ chứa liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
3. Cách xác định kiểu liên kết
a. Xác định định tính
- Liên kết giữa hai nguyên tử của cùng một nguyên tố phi kim là liên kết cộng hoá trị. Ví dụ H2, Cl2, O3, S8
- Liên kết giữa hai nguyên tử của hai nguyên tố phi kim khác nhau là liên kết cộng hoá trị có cực, ví dụ như HCl, H2O
- Liên kết giữa nguyên tử kim loại và nguyên tử phi kim là liên kết ion
- Liên kết giữa các nguyên tử kim loại là liên kết kim loại (sẽ học ở phần đại cương kim loại lớp 12)
b. Xác định định lượng
Xác định định lượng dựa vào hiệu số độ âm điện của 2 nguyên tố tham gia liên kết là Δ (lấy giá trị đại số không nhân với hệ số). Dựa vào Δ có thể xác định được loại liên kết theo bảng sau:
|
Hiệu độ âm điện |
0 ≤ Δ < 0,4 |
0,4 ≤ Δ < 1,7 |
Δ ≥ 1,7 |
|
Loại liên kết |
Cộng hóa trị không phân cực |
Cộng hóa trị phân cực |
Ion |
Mời các bạn tham gia giải các bài tập sau cùng hochoaonline.net:
