Chương 1. Sự điện li
Sự điện li và chất điện li
- Chi tiết
- Chuyên mục: Chương 1. Sự điện li
- Được viết ngày Chủ nhật, 15 Tháng 3 2015 10:50
- Viết bởi Nguyễn Văn Đàm
I. KHÁI NIỆM SỰ ĐIỆN LI VÀ CHẤT ĐIỆN LI
- Quá trình phân li của các chất trong nước (hoặc khi nóng chảy) ra ion được gọi là sự điện li.
- Những chất tan trong nước (hoặc nóng chảy) phân li ra ion được gọi là những chất điện li. Axit, bazơ và muối là các chất điện li.
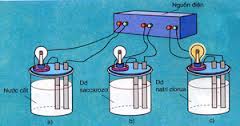
Sơ đồ thí nghiệm về sự điện li
II. PHÂN LOẠI CHẤT ĐIỆN LI
Chất điện li được chia thành 2 loại là chất điện li mạnh và chất điện li yếu:
1. Chất điện li mạnh
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Chất điện li mạnh gồm:
+ Các axit mạnh như: HCl, HNO3, H2SO4, HBr, HI, HClO4, HClO3...
+ Các bazơ tan như: NaOH, KOH, Ca(OH)2, Ba(OH)2...
+ Hầu hết các muối.
- Phương trình điện li của chất điện li mạnh sử dụng mũi tên 1 chiều (→).
2. Chất điện li yếu
- Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hoà tan phân li thành ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Các chất điện li yếu gồm:
+ Các axit trung bình và yếu như: H2S, H2CO3, H3PO4, HCOOH...
+ Các bazơ không tan như: Mg(OH)2, Fe(OH)2, Fe(OH)3...
- Phương trình điện li của chất điện li yếu sử dụng 2 mũi tên ngược chiều (→).
- Sự điện li của chất điện li yếu được đánh giá bằng đại lượng độ điện li α:
α = số phân tử phân li/tổng số phân tử hoà tan
Sau đây, mời các bạn tham khảo các bài tập cùng hochoaonline.net:
