Chuyên đề 3. Phi kim 1 - Nhóm VIIA và VIA
Lưu huỳnh đioxit
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 14:21
- Viết bởi Nguyễn Văn Đàm
Lưu huỳnh đioxit (SO2) còn có thể được gọi là (sunfu đioxit, khí sunfurơ, lưu huỳnh (IV) oxit, sufu (IV) oxit, anhiđrit sunfurơ).
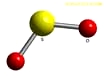
1. Tính chất vật lí
Là chất khí không màu, nặng hơn không khí, mùi hắc, độc, tan và tác dụng được với nước.
Axit sunfuric loãng
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 14:40
- Viết bởi Nguyễn Văn Đàm
Axit sunfuric là một trong những axit vô cơ quan trọng hàng đầu trong đời sống và sản xuất.
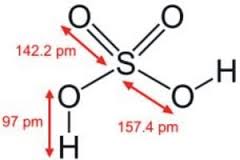
1. Tính chất vật lí
- H2SO4 là chất lỏng, nhớt, nặng hơn nước, khó bay hơi và tan vô hạn trong nước.
- H2SO4 đặc hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại vì có thể gây bỏng. H2SO4 có khả năng làm than hóa các hợp chất hữu cơ.
Axit sunfuric đặc
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 15:00
- Viết bởi Nguyễn Văn Đàm
H2SO4 đặc hút nước mạnh và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại vì có thể gây bỏng. H2SO4 có khả năng làm than hóa các hợp chất hữu cơ.
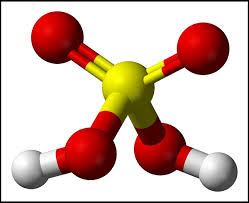
1. H2SO4 đặc là axit mạnh
- Làm quỳ tím chuyển thành màu đỏ.
- Tác dụng với bazơ (trong đó kim loại đã có mức oxi hóa cao nhất) tạo thành muối và nước.
- Tác dụng với oxit bazơ (trong đó kim loại đã có mức oxi hóa cao nhất) tạo thành muối và nước.
- Tác dụng với muối (trong đó kim loại đã có số oxi hóa cao nhất) tạo thành muối và nước.
Page 2 of 2
- Trang trước
- 1
- 2
- Trang sau