Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
pH và môi trường của dung dịch
- Chi tiết
- Chuyên mục: Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
- Được viết ngày Thứ năm, 05 Tháng 3 2015 18:02
- Viết bởi Nguyễn Văn Đàm
1. Tích số ion của nước
- Nước là chất điện li rất yếu (ở nhiệt độ thường, cứ 555 triệu phân tử nước chỉ có 1 phân tử phân li thành ion).
- Tích số: KH2O = [H+].[OH-] = 1,0.10-7 được gọi là tích số ion của nước. Giá trị này được tính với nước ở 250c. Một cách gần đúng, có thể coi giá trị tích số ion của nước là hằng số cả trong dung dịch loãng của các chất khác nhau.
2. Khái niệm về pH


Giấy chỉ thị màu axit - bazơ và máy đo pH để xác định pH của dung dịch
Dung dịch và phản ứng trao đổi ion
- Chi tiết
- Chuyên mục: Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
- Được viết ngày Thứ năm, 05 Tháng 3 2015 17:47
- Viết bởi Nguyễn Văn Đàm
1. Điều kiện tồn tại dung dịch
Dung dịch các chất điên li chỉ tồn tại được nếu thoả mãn đồng thời cả 2 điều kiện:
- Có sự trung hoà về điện (tổng số mol điện tích âm = tổng số mol điện tích dương).
Số molđiện tích = số molion.điên tíchion
- Các ion trong dung dịch không có phản ứng với nhau.
Các ion trong dung dịch thường kết hợp với nhau theo hướng: tạo kết tủa, tạo chất khí, tạo chất điện lli yếu (các ion có tính khử có thể phản ứng với các ion có tính oxi hoá theo kiểu phản ứng oxi hoá - khử).
2. Phản ứng trao đổi ion trong dung dịch chất điện li
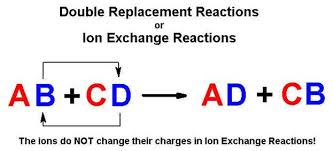
Phản ứng trao đổi ion
Thuyết axit - bazơ
- Chi tiết
- Chuyên mục: Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
- Được viết ngày Thứ năm, 05 Tháng 3 2015 17:20
- Viết bởi Nguyễn Văn Đàm
I. AXIT
1. Định nghĩa
- Định nghĩa:
+ Thuyết điện li: Axit là chất khi tan trong nước phân li ra ion H+.
+ Thuyết Bronsted: Axit là những chất có khả năng cho proton (ion H+).
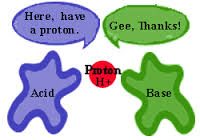
Axit và bazơ theo quan điểm của Bronsted
Sự điện li và chất điện li
- Chi tiết
- Chuyên mục: Chuyên đề 5. Thuyết axit - bazơ. Phản ứng trong dung dịch
- Được viết ngày Thứ năm, 05 Tháng 3 2015 16:39
- Viết bởi Nguyễn Văn Đàm
I. KHÁI NIỆM SỰ ĐIỆN LI VÀ CHẤT ĐIỆN LI
- Quá trình phân li của các chất trong nước (hoặc khi nóng chảy) ra ion được gọi là sự điện li.
- Những chất tan trong nước (hoặc nóng chảy) phân li ra ion được gọi là những chất điện li. Axit, bazơ và muối là các chất điện li.

Thí nghiệm về sự điện li