Chuyên đề 3. Phi kim 1 - Nhóm VIIA và VIA
Lí thuyết về halogen và hợp chất
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Chủ nhật, 25 Tháng 1 2015 17:43
- Viết bởi Nguyễn Văn Đàm
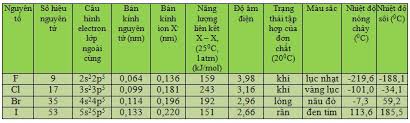
I. ĐƠN CHẤT HALOGEN
1. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen: nhóm VIIA.
- Nhóm halogen: gồm Flo (F), Clo (Cl), Brom (Br) và Iot (I).
Clo
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ hai, 26 Tháng 1 2015 09:04
- Viết bởi Nguyễn Văn Đàm
1. Tính chất vật lí
- Clo là chất khí, màu vàng lục, mùi xốc, nặng hơn không khí.

- Khí clo tan vừa phải trong nước tạo thành nước clo có màu vàng nhạt. Clo tan nhiều trong các dung môi hữu cơ.
- Khí clo độc.
Lí thuyết về HCl
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ hai, 26 Tháng 1 2015 10:29
- Viết bởi Nguyễn Văn Đàm
HCl và muối clorua là những hợp chất rất quan trọng của nguyên tố clo.
A. HIĐRO CLORUA, AXIT CLOHIĐRIC
I. Tính chất vật lí
- Hiđro clorua là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
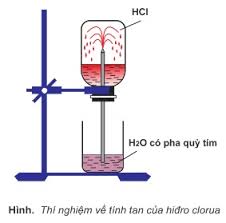
- Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
Phản ứng của HCl với kim loại
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 10:09
- Viết bởi Nguyễn Văn Đàm
Bài toán HCl với kim loại là bài toán phổ biến thường gặp. HCl tác dụng được với các kim loại đứng trước H2 trong dãy hoạt động hóa học của kim loại tạo ra sản phẩm là muối và H2 theo phương trình tổng quát:
2M + 2nHCl → 2MCln + nH2
Chú ý:
Phản ứng của HCl với các hợp chất
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 11:06
- Viết bởi Nguyễn Văn Đàm
Ngoài phản ứng với kim loại, tính axit của HCl còn được thể hiện khi cho HCl tác dụng với oxit bazơ, với bazơ và với các muối khác.
Cụ thể như sau:
1. Tác dụng với oxit kim loại → muối (trong đó kim loại giữ nguyên hóa trị) + H2O.
Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
Chú ý:
Hợp chất của halogen
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 11:41
- Viết bởi Nguyễn Văn Đàm
I. HIĐRO HALOGENUA (HX) VÀ MUỐI HALOGENUA
1. Hiđro halogenua
- Tất cả đều là chất khí, tan nhiều trong nước, điện li hoàn toàn (trừ HF) tạo thành dung dịch axit mạnh.

- Thứ tự tính axit và tính khử tăng dần: HF < HCl < HBr < HI.
- Tính axit mạnh của HCl, HBr và HI:
Lí thuyết về oxi, lưu huỳnh và hợp chất của chúng
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 11:52
- Viết bởi Nguyễn Văn Đàm
I. KHÁI QUÁT VỀ NHÓM OXI, LƯU HUỲNH
- Nhóm VIA gồm các nguyên tố: O, S, Se và Te, Po.
+ O là nguyên tố phổ biến nhất trên trái đất.
+ S có nhiều trong lòng đất.
+ Se là chất bán dẫn màu nâu đỏ.
+ Te là chất rắn, màu xám, thuộc loại nguyên tố hiếm.
+ Po là nguyên tố kim loại có tính phóng xạ.
- Cấu hình e lớp ngoài cùng: ns2np4.

Oxi và Ozon
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 13:57
- Viết bởi Nguyễn Văn Đàm
I. OXI

1. Tính chất vật lí
Là chất khí không màu, không mùi, nặng hơn không khí. Ít tan trong nước.
2. Tính chất hóa học
Là một phi kim hoạt động (do có độ âm điện lớn 3,44 chỉ kém F).
Lưu huỳnh
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 14:03
- Viết bởi Nguyễn Văn Đàm
Lưu huỳnh có tên quốc tế là sunfu.
1. Tính chất vật lí

Là chất bột màu vàng, không tan trong nước. S có 6e ở lớp ngoài cùng → dễ nhận 2e thể hiện tính oxi hóa mạnh. Tính oxi hóa của S yếu hơn so với O.
2. Tính chất hóa học
- S có 6e ở lớp ngoài cùng nên dễ nhận thêm 2e thể hiện tính oxi hoá mạnh:
S + 2e → S2-
- Các mức oxi hóa có thể có của S: -2, 0, +4, +6. Ngoài tính oxi hóa, S còn có tính khử.
Hiđro sunfua và axit sunfuhiđric
- Chi tiết
- Chuyên mục: Chuyên đề 3. Phi kim 1- Nhóm VIIA và VIA
- Được viết ngày Thứ bảy, 07 Tháng 2 2015 14:13
- Viết bởi Nguyễn Văn Đàm
Hiđro sunfua và axit sunfuhiđric đều có công thức phân tử là H2S nhưng tuỳ thuộc vào trạng thái tồn tại mà sử dụng ten gọi khác nhau.
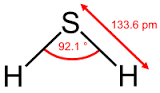
1. Tính chất vật lí
- Hiđro sunfua (H2S) là chất khí không màu, mùi trứng thối, độc, ít tan trong nước.
- Khi tan trong nước tạo thành dung dịch axit yếu sunfuhiđric.
2. Tính chất hóa học
- Dung dịch H2S có tính axit yếu (yếu hơn axit cacbonic).