Chuyên đề 13. Dẫn xuất halogen, ancol, phenol
Lí thuyết về phenol
- Chi tiết
- Chuyên mục: Chuyên đề 13. Dẫn xuất halogen, ancol, phenol.
- Được viết ngày Thứ bảy, 24 Tháng 1 2015 11:00
- Viết bởi Nguyễn Văn Đàm
I. ĐỊNH NGHĨA
- Phenol là những hợp chất hữu cơ trong phân tử có nhóm OH liên kết trực tiếp với nguyên tử C của vòng benzen.
Chú ý: Phân biệt giữa phenol và ancol thơm (có vòng benzen nhưng nhóm OH liên kết với C của nhánh).
- Thường chỉ xét phenol đơn giản nhất là C6H5OH. Ngoài ra còn có crezol CH3–C6H4–OH, HO-C6H4-OH (o-catechol, m-rezoxinol, p-hidroquinol).
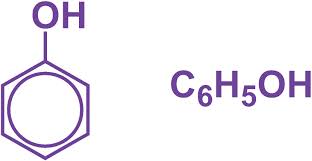
Công thức cấu tạo và công thức phân tử của phenol
II. TÍNH CHẤT VẬT LÍ
- Phenol ít tan trong nước lạnh, tan nhiều trong nước nóng nên dùng để tách bằng phương pháp chiết.
- Là chất rắn, độc, khi để lâu trong không khí bị chảy rữa do hút ẩm và chuyển thành màu hồng.
III. TÍNH CHẤT HOÁ HỌC
1. Cấu tạo của phân tử phenol
- Gốc C6H5 hút e làm cho liên kết O-H trong phân tử phenol phân cực hơn liên kết O-H của ancol vì vậy H trong nhóm OH của phenol linh động hơn H trong nhóm OH của ancol và biểu hiện được tính axit yếu (phenol có tên gọi khác là axit phenic).
- Do có hiệu ứng liên hợp nên cặp e chưa sử dụng của nguyên tử O bị hút về phía vòng benzen làm cho mật độ e của vòng benzen đặc biệt là các vị trí o-, p- tăng lên nên phản ứng thế vào vòng benzen của phenol dễ hơn và ưu tiên vào vị trí o-, p- .
Vì vậy nhóm OH và gốc phenyl trong phân tử phenol ảnh hưởng lẫn nhau.
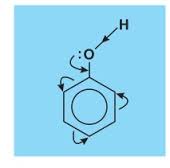
2. Tính chất hóa học
a. Tính chất của nhóm OH
- Tác dụng với kim loại kiềm:
C6H5OH + Na → C6H5ONa + 1/2H2
→ Phản ứng này dùng để phân biệt phenol với anilin.
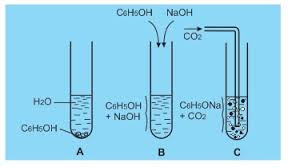
- Tác dụng với dung dịch kiềm:
C6H5OH + NaOH → C6H5ONa + H2O
Ancol không có phản ứng này chứng tỏ H của phenol linh động hơn H của Ancol và chứng minh ảnh hưởng của gốc phenyl đến nhóm OH.
→ Phản ứng này dùng để tách phenol khỏi hỗn hợp anilin và phenol sau đó thu hồi lại phenol nhờ phản ứng với các axit mạnh hơn:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
C6H5ONa + HCl → C6H5OH + NaCl
Phenol bị CO2 đẩy ra khỏi muối → phenol có tính axit yếu hơn axit cacbonic → phenol không làm đổi màu quỳ tím. (dùng axit mạnh đẩy axit yếu ra khỏi muối để chứng minh trật tự tính axit của các chất). Phản ứng này cũng chứng minh được ion C6H5O- có tính bazơ.
b. Phản ứng thế vào vòng benzen
- Thế Brom: phenol tác dụng với dung dịch brom tạo 2,4,6 - tribromphenol kết tủa trắng:
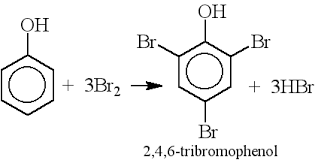
→ Phản ứng này dùng để nhận biết phenol khi không có mặt của anilin và chứng minh ảnh hưởng của nhóm OH đến khả năng phản ứng của vòng benzen.
- Thế Nitro: phenol tác dụng với HNO3 đặc có xúc tác H2SO4 đặc, đun nóng tạo 2,4,6 - trinitrophenol (axit picric):
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 3H2O
Chú ý: Ngoài phenol, tất cả những chất thuộc loại phenol mà còn nguyên tử H ở vị trí o, p so với nhóm OH đều có thể tham gia vào 2 phản ứng thế brom và thế nitro.
c. Phản ứng tạo nhựa phenolfomanđehit
IV. ĐIỀU CHẾ
1. Từ benzen
C6H6 → C6H5Cl → C6H5ONa → C6H5OH
C6H6 → C6H5CH(CH3)2 → C6H5OH
2. Chưng cất nhựa than đá
- Nhựa than đá + NaOH dư.
- Chiết để lấy lớp nước có C6H5ONa.
- C6H5ONa + H+ → C6H5OH.
Mời các bạn cùng làm các bài tập sau của Hochoaonline.net để củng cố các kiến thức lí thuyết về phenol: